代謝・内分泌、ひいては生命の本質は何か?
私自身は物事の本質を考える時に時間をさかのぼって考えるのは一つの有効な手段だと考えています。生命の進化をさかのぼると、1つの細胞として生命が誕生した時に核酸のような自己複製装置、自らを外界と隔てる細胞膜脂質、そして代謝が存在していたと考えられています。この最初の構成要素を上手に組み合わせながら生命は高度に進化してきました。内分泌は細胞間の情報伝達なので、多細胞生物に進化してから発達したもので、生命の高度化、複雑化に重要な役割を果たしています。
こうした背景から核酸、脂質、代謝といったところはほぼ全ての生命現象に大きく影響しており、核酸や脂質を含めた幅広い代謝の変動をモニターする分子CtBP2を代表例に、幅広く代謝・内分泌の研究を行っています。
筑波大学医学医療系 内分泌代謝・糖尿病内科教授 関谷元博
関谷グループ

グループリーダー
関谷 元博
代謝産物センサー分子を軸にした代謝や生命現象の新しい理解と臨床応用
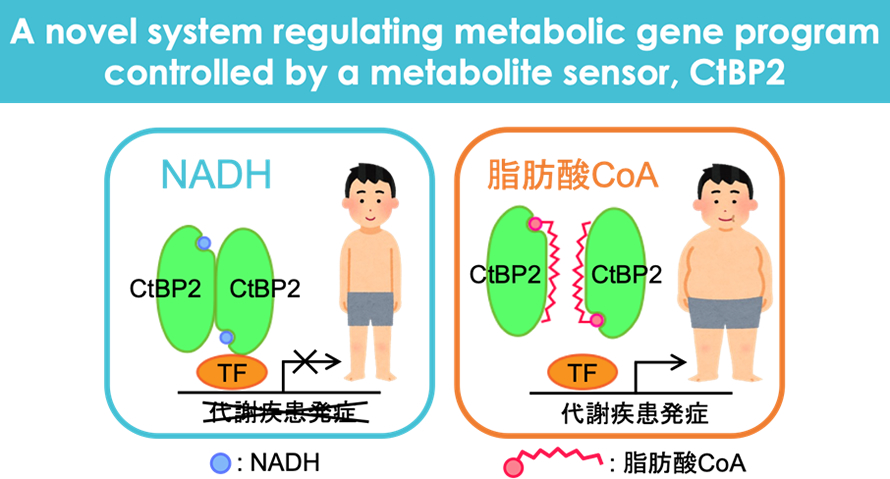
我々はCtBP2と呼ばれる転写抑制因子が代謝産物と結合するポケット構造を有し、結合する代謝産物によって活性が変動する代謝産物センサーとして働いており、その理解を進めると全く新しい形の代謝の理解、ひいては生命現象の理解につながることを見出しました。NADH/NAD+は様々な代謝と連動して制御されている代謝産物ですが、CtBP2は健常人ではこれらと結合しており活性化、メタボリックシンドロームの発症に重要な転写因子に結合し、防御的に働いています。一方、肥満病態では脂質の1種である脂肪酸CoAが増加しており、CtBP2のポケット構造に脂肪酸CoAが結合、これによりCtBP2の不活性化が起こり健常人では抑制されていたメタボリックシンドローム関連遺伝子の発現が上昇、病態形成につながります。
こうした発見は従来説明が十分できなかった代謝の基礎的な理解を進めるだけでなく、CtBP2のポケット構造を標的に新しいメタボリックシンドロームの治療戦略が立てられることを意味しており、我々はこうした新しい理解とともに創薬標的としての理解を深めるためその分子構造的な基盤も明らかにしました(Sekiya M et al. Nat Commun, 2021)。従来のメタボリックシンドロームの治療戦略はインスリンなどホルモン作用を介したものが中心で、インスリン治療は肥満を助長してしまうことに端的に表されるように様々な限界がありました。実際に多彩な薬剤が開発された現在もメタボリックシンドロームの患者さんは増加の一途です。また基礎的な理解においてもCtBP2を中心とした新しい代謝システムは代謝疾患のみならず、がん、免疫、発生など領域横断的な生命現象に大きな役割を果たしているものと思われます。
我々は代謝産物センサーを手掛かりにしながら、広く代謝がどのように生命現象を調節しているのか、全く新しい角度から理解したいと思っています。端的に言えば還元力の源となっている電子、生命のエネルギーに必須な酸素、そして脂質などの代謝産物。先行論文のつなぎ合わせのような研究が多くなされる昨今ですが、まっさらな雪に足跡をつけていくような心地よさのある研究です。そしてこうした基礎的な理解を日々の診療で向き合っている患者さんの笑顔につなげられるよう明日の医学を切り開く気概で研究に取り組んでいます。
大崎グループ

グループリーダー
大崎 芳典
コレステロール生合成系の生体における生理機能の解明
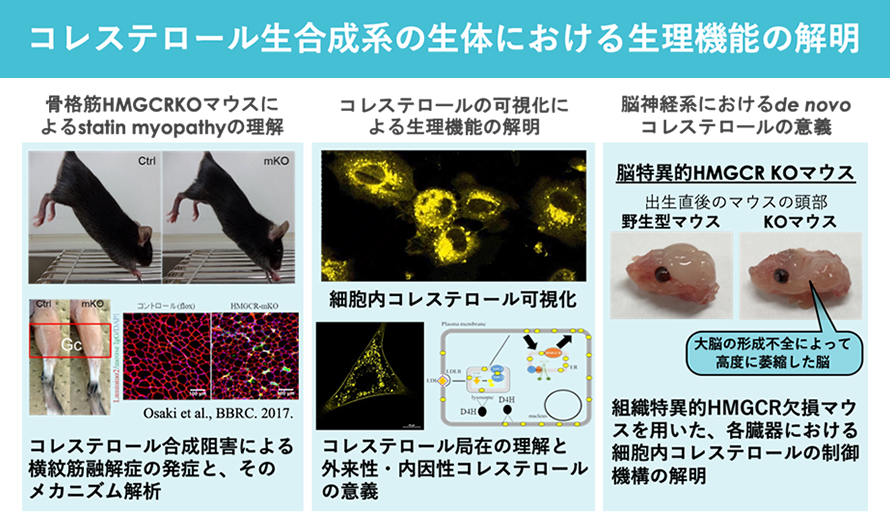
高コレステロール血症に対する代表的な治療薬であるスタチンは、副作用として横紋筋融解症を発症することが大きな問題となっています。スタチンはコレステロール合成系の律速段階酵素HMGCRの阻害剤ですが、筋肉におけるスタチンの作用によってコレステロール合成が抑制されることが副作用の発生に関わるかどうかはこれまで明らかにされていませんでした。そこで我々のグループでは、筋肉でHMGCRを欠損したマウスを作成し、そのマウスがスタチンによる横紋筋融解症のモデルマウスとなることを証明しました(Osaki et al. BBRC, 2015)。また、脳神経系でのみHMGCRを欠損した臓器特異的欠損マウスを作成し、これらのマウスの解析を通じて臓器毎の細胞内コレステロールの制御機構の解明および新たなコレステロール代謝機構の発見と治療への応用を目指しています。
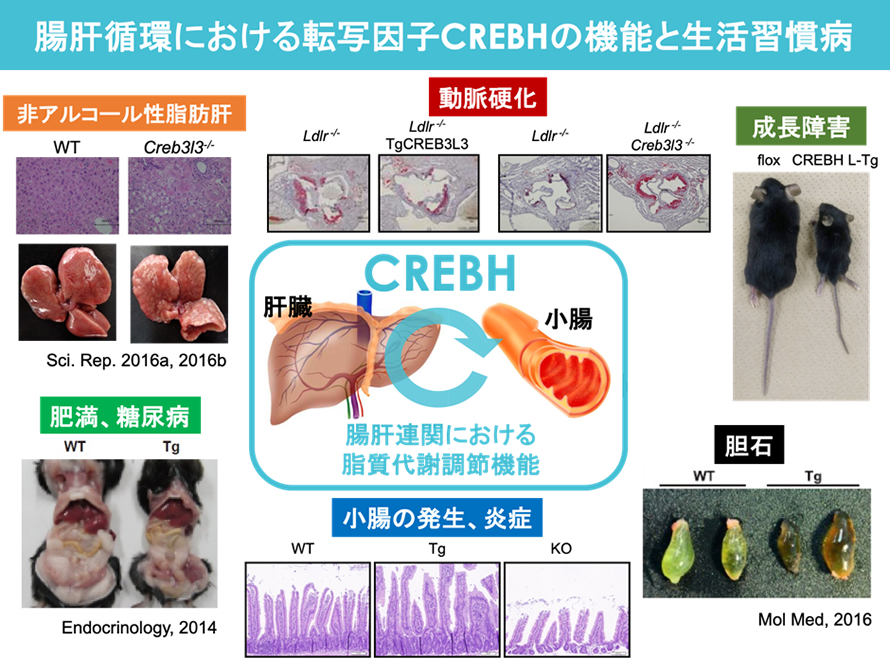
腸肝循環における転写因子CREBHの機能と生活習慣病
我々のグループでは小胞体に存在する膜結合型転写因子群(CREBH、SREBP)の機能解析を行っています。SREBPは全身の組織で発現するのに対し、CREBHは栄養代謝の根源にある栄養吸収組織である小腸と栄養代謝組織である肝臓にのみ発現している転写因子です。
我々は、CREBHが肝臓において生活習慣病改善ホルモンFibroblast Growth Factor21(FGF21)の発現を直接上昇させ、食事性肥満を抑制することを報告しました(Nakagawa et al. Endocrinology, 2014)。さらに、CREBHは脂質代謝を改善させる核内受容体である転写因子PPARAの発現を制御することで脂質代謝を改善させ、CREBHとPPARAはお互いに発現を制御しあうオートループ活性化機構を構築することで、効果的に脂質代謝を改善することを報告しました(Nakagawa et al. Sci Rep, 2016)(Nakagawa and Shimano. Int J Mol Sci, 2018)。実際にCREBH欠損マウスを作成し解析を進めると、食餌誘導型の非アルコール性脂肪肝が早期に悪化し、肝炎を生じさせることを確認することができました(Nakagawa et al. Sci Rep, 2016)。他方、小腸のCREBHは小腸においてコレステロール吸収トランスポーターNPC1L1の発現を抑止することで血中コレステロールを低下させ、それゆえに小腸CREBH過剰発現マウスは高コレステロール食により誘導される胆石形成を抑制することを見出しました(Kikuchi et al. Mol Metab, 2016)。
現在我々は、非アルコール性脂肪肝、動脈硬化などの病態形成における分子レベルの解明を大きな目標に掲げ、CREBHを中心とした肝臓と小腸の連関(腸肝循環)が栄養代謝に与える影響の解析や、他の末梢組織に与える影響について注目し、そのメカニズムの解明を目指しています。さらに、CREBHは小胞体からゴルジ体、核へと細胞内局在を変え、さらに翻訳後修飾(タンパク切断、糖鎖修飾など)によってその活性が制御されており、これらのメカニズムと栄養代謝との関係についても解析を進めています。
松坂グループ

グループリーダー
松坂 賢
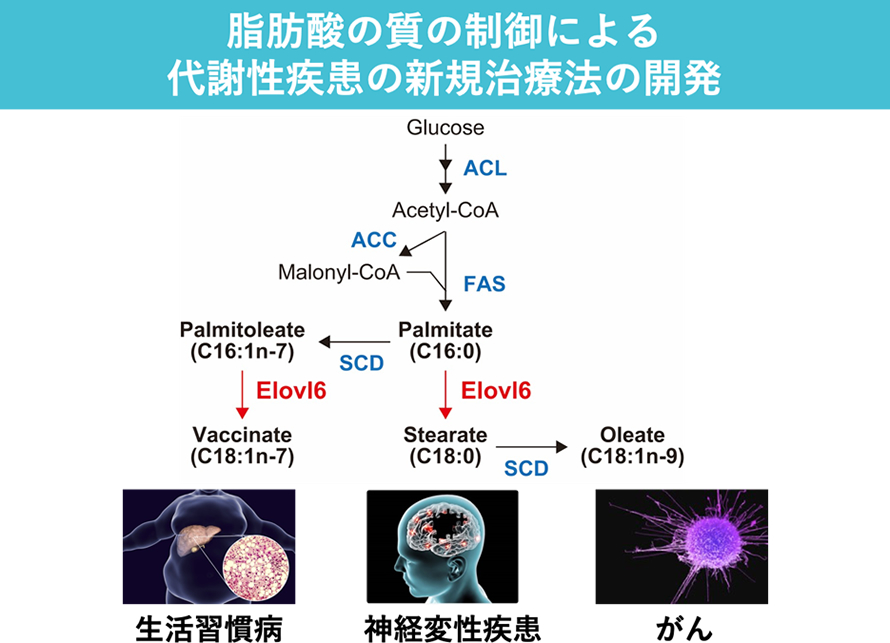
脂肪酸の質の違いによる代謝制御および疾患発症の分子メカニズムの解明
近年の肥満ならびに生活習慣病患者の増加により、これら疾患の治療および予防に対しての有効な方法が早急に求められています。我々は、脂質合成転写因子SREBP の新規標的遺伝子の探索過程において、炭素数12-16の飽和・一価不飽和脂肪酸を基質とする脂肪酸伸長酵素Elovl6のクローニングに成功しました(Matsuzaka T et al. J Lipid Res, 2002)。さらに、Elovl6欠損マウスの作製、解析を行い、このマウスでは脂肪酸組成が鎖長や不飽和度に応じて著しく変化するとともに、食餌性および遺伝性肥満によるインスリン抵抗性が、肥満が持続した状態においても改善されることを明らかにしました(Matsuzaka T et al. Nat Med, 2007)。すなわち、組織や細胞に蓄積する脂質の「量」のみならず、脂肪酸の鎖長、不飽和度やそのバランスといった脂質の「質」もエネルギー代謝および生活習慣病発症の重要な決定因子であり、Elovl6の阻害は肥満が持続した状態においてもインスリン抵抗性、糖尿病、心血管リスクを改善する新たな治療法となる可能性があります。
そこで、本研究では、「脂肪酸の質の違い」という新しい視点から、生活習慣病の新しい予防法・治療法の開発を試みます。Elovl6遺伝子改変マウスの表現型解析、脂質メタボローム解析、トランスクリプトーム解析、臨床サンプルでの検証を統合的に行い、脂肪酸伸長酵素Elovl6を通じて脂肪酸の質の違い(脂肪酸多様性)の生理的意義とその分子メカニズムを理解した上で、疾患に対する根本的な予防法・治療法の開発を目指します。
宮本グループ

グループリーダー
宮本 崇史
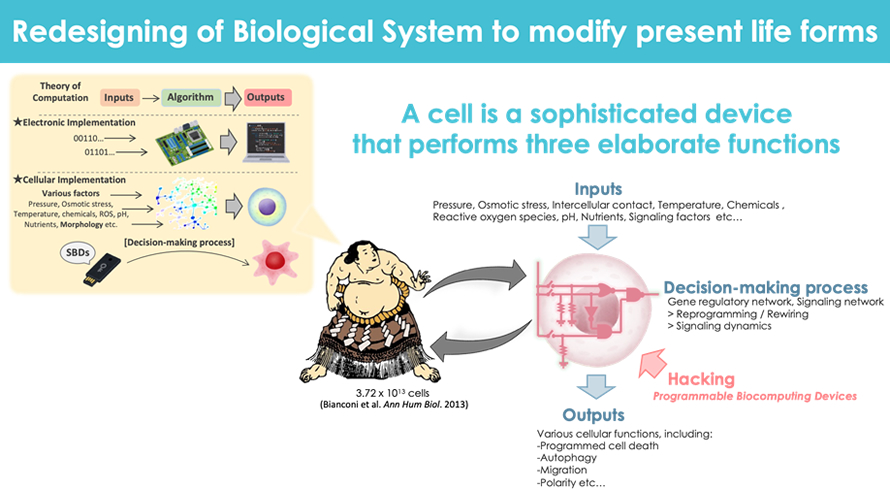
代謝応答性トランスオミクスネットワークの可視化および操作技術の開発
細胞は周辺環境の情報を感知・処理する過程でトランスクリプトーム・プロテオーム・メタボロームなど異なる階層の情報を動的に変化させていきます。この際、各階層のオミクス情報は独立的ではなく、密接に連動した『トランスオミクスネットワーク』としてコード化され、細胞はそのコード化された情報に基づいて適切な機能を状況に応じて選択・実行していると考えられています。これらオミクス情報の中において、メタボローム情報は他の階層のオミクス情報の結果が集約したものであると同時に、他階層のオミクス情報やそれらによって構築される細胞内シグナルダイナミクスに大きな影響を与えることが我々などによって報告されています。
我々のグループは、ある代謝情報の変化が特定のアウトプットへ帰結する過程で構成される情報網を『代謝応答性トランスオミクスネットワーク』として定義し、還元論的なアプローチ(オミクス解析や情報ダイナミクスの可視化)と構成論的なアプローチ(Programmable Biocomputing Devicesの開発)を組み合わせることによって、その全容解明を試みています。